NEUTRALIZACIÓN
TRABAJO DE QUIMICA
LAURA DANIELA MEJÍA RENGIFO
IET EXALUMNAS DE LA PRESENTACIÓN
ÁREA CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL
IBAGUÉ
2018
INTRODUCCIÓN
En este blog hablaremos un poco sobre el neutralizacion, ph e inicadores, explicaremos cada uno de los temas y pondremos unos ejemplos, esto se complementara con unas imágenes sacas de la aplicación yenka.
Neutralización
Se llama neutralización a la reacción que se produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como producto una sal y agua. Se le conoce también como la reacción química formada de un ácido con una base.
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor. En una reacción química; cuerpos o sustancias experimentan transformaciones que alteran su composición dando origen a: sustancias nuevas.
La ecuación general que representa este tipo de reacción es:
ÁCIDO + BASE --> SAL + AGUA
Por ejemplo, la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
Imagen de la aplicación de yenka
PH e indicadores
Un indicador de pH es una sustancia que permite medir el pH de un medio.
Habitualmente, se utilizan como indicador a sustancias químicas que cambian su color al cambiar el pH de la disolución.1El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie.
Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Existen muchos otros indicadores, los más comunes son:
- Violeta de Genciana (Metil violeta). Tiene un intervalo de viraje de 0.0-2.0, por debajo del pH tiñe en color amarillo, sobre el intervalo de azul-violeta.
- Amarillo de metilo. Su intervalo de se 2.9-4.0, por lo que se usa en sustancias ácidas. Por debajo de su rango es rojo y sobre él se torna amarillo.
- Azul de bromofenol. Su rango de viraje es de 3.0-4.6, con colores amarillos y purpura, por debajo y sobre el intervalo, respectivamente.
- Azolitmina. Puede ser usado tanto en productos ácidos, neutros o bases, su intervalo de viraje es de 4.5-8.5. En sustancias muy ácidas se torna rojo y en alcalinas azul.
- Azul de Bromotimol. Su rango va de los ácidos leves al pH neutro (6.0-7.6), sus colores indicativos son amarillo por debajo del intervalo, y azul sobre el intervalo.
Imagenes de la aplicación de yenka
Un indicador de pH es una sustancia que permite medir el pH de un medio.
Habitualmente, se utilizan como indicador a sustancias químicas que cambian su color al cambiar el pH de la disolución.1El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie.
Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Existen muchos otros indicadores, los más comunes son:
- Violeta de Genciana (Metil violeta). Tiene un intervalo de viraje de 0.0-2.0, por debajo del pH tiñe en color amarillo, sobre el intervalo de azul-violeta.
- Amarillo de metilo. Su intervalo de se 2.9-4.0, por lo que se usa en sustancias ácidas. Por debajo de su rango es rojo y sobre él se torna amarillo.
- Azul de bromofenol. Su rango de viraje es de 3.0-4.6, con colores amarillos y purpura, por debajo y sobre el intervalo, respectivamente.
- Azolitmina. Puede ser usado tanto en productos ácidos, neutros o bases, su intervalo de viraje es de 4.5-8.5. En sustancias muy ácidas se torna rojo y en alcalinas azul.
- Azul de Bromotimol. Su rango va de los ácidos leves al pH neutro (6.0-7.6), sus colores indicativos son amarillo por debajo del intervalo, y azul sobre el intervalo.
Imagenes de la aplicación de yenka
Fenolftaleina
La fenolftaleína, de fórmula C20H14O4, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disoluciones básicas toma un color rosado con un punto de viraje entre pH=8,2 (incoloro) y pH=10 (magenta o rosado).
La fenolftaleína, de fórmula C20H14O4, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disoluciones básicas toma un color rosado con un punto de viraje entre pH=8,2 (incoloro) y pH=10 (magenta o rosado).
Universal
Tornasol
El Papel tornasol o Papel pH es utilizado para medir la concentración de Iones Hidrogenos contenido en una sustancia o disolución. Mediante la escala de pH, la cual es clasificada en distintos colores y tipos. El papel tornasol se sumerge en soluciones y luego se retira para su comparación con la escala de pH
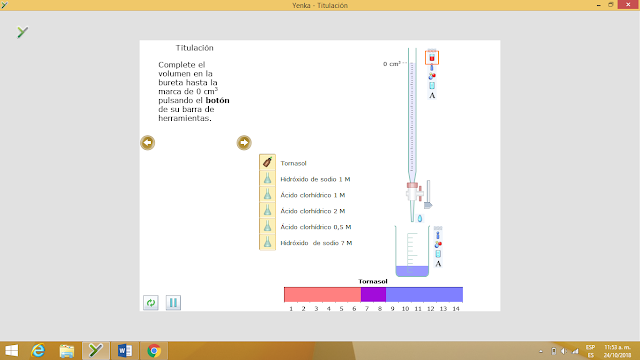
Titulación
Es el método por el cual se determina una cantidad desconocida de una sustancia particular, mediante la adición de un reactivo estándar que reacciona con ella en proporción definida y conocida.
La adición de un reactivo estándar (un reactivo de concentración conocida y frecuentemente denominado como reactivo titulado) se regula y se mide de alguna forma, requiriéndose un método de indicación para saber cuando la cantidad de reactivo normal juntado y precisamente la suficiente para reaccionar cuantitativamente con la sustancia que se determina.
Las titulaciones se realizan casi siempre con soluciones o disoluciones, sin embargo también es fácil realizarlas con sustancias en los estados gaseosos, sólido y de fusión, si se dispone de equipo adecuado.
Imágenes de la aplicación de yenka
En estas imágenes podemos notar el proceso que realiza la titulacion:












NO SIGUIÓ EL DERROTERO INDICADO CADA INFORME ERA APARTE FALTO MAS MARCO TEÓRICO 3.3
ResponderBorrar